Scheme 1: 焦耳加热法制备HEOs示意图
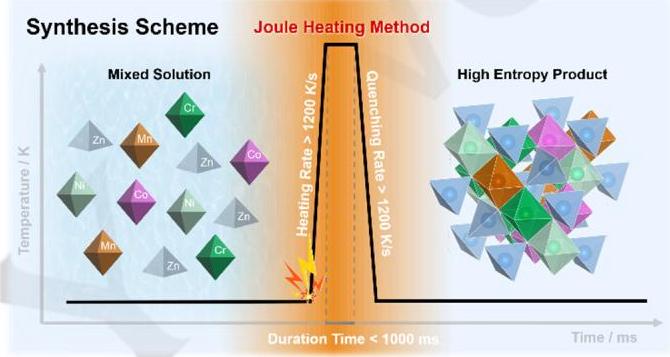
示意图展示了使用焦耳加热法合成高熵氧化物(HEOs)的过程。该方法通过对浸渍均匀溶液的碳布施加直接高温脉冲(加热速率>1200 K/s),避免了传统高温固相合成中因耗时扩散过程导致的显著相分离。
第一作者: 管浩民 (Hao-Min Guan)
通讯作者: 王开学 (Kai-Xue Wang), 陈接胜 (Jie-Sheng Chen)
所属机构: 上海交通大学
采用焦耳加热法合成具有路易斯碱性的尖晶石型高熵氧化物(LB-HEO)。选择五种过渡金属元素(Cr, Mn, Co, Ni, Zn),其中Zn占据四面体位点,Cr、Mn、Co、Ni占据八面体位点。通过XRD、SEM、HR-TEM、EDS、XAFS和XPS对材料结构、形貌和元素分布进行表征。
将LB-HEO作为正极催化剂应用于锂氧电池,进行循环伏安(CV)、恒电流充放电(GCD)、电化学阻抗谱(EIS)和电位间歇滴定技术(PITT)测试,评估其电化学性能。
通过CO₂淬灭实验结合拉曼光谱和FT-IR光谱验证路易斯碱性的存在;利用XPS深度剖析研究Li₂O₂的化学环境;采用DFT计算分析电子结构。
使用Fe替代Cr合成对照样品N-HEO,以及使用低熵尖晶石ZnCr₂O₄和ZnFe₂O₄作为对比,验证高熵效应和路易斯碱性的作用。

示意图展示了使用焦耳加热法合成高熵氧化物(HEOs)的过程。该方法通过对浸渍均匀溶液的碳布施加直接高温脉冲(加热速率>1200 K/s),避免了传统高温固相合成中因耗时扩散过程导致的显著相分离。
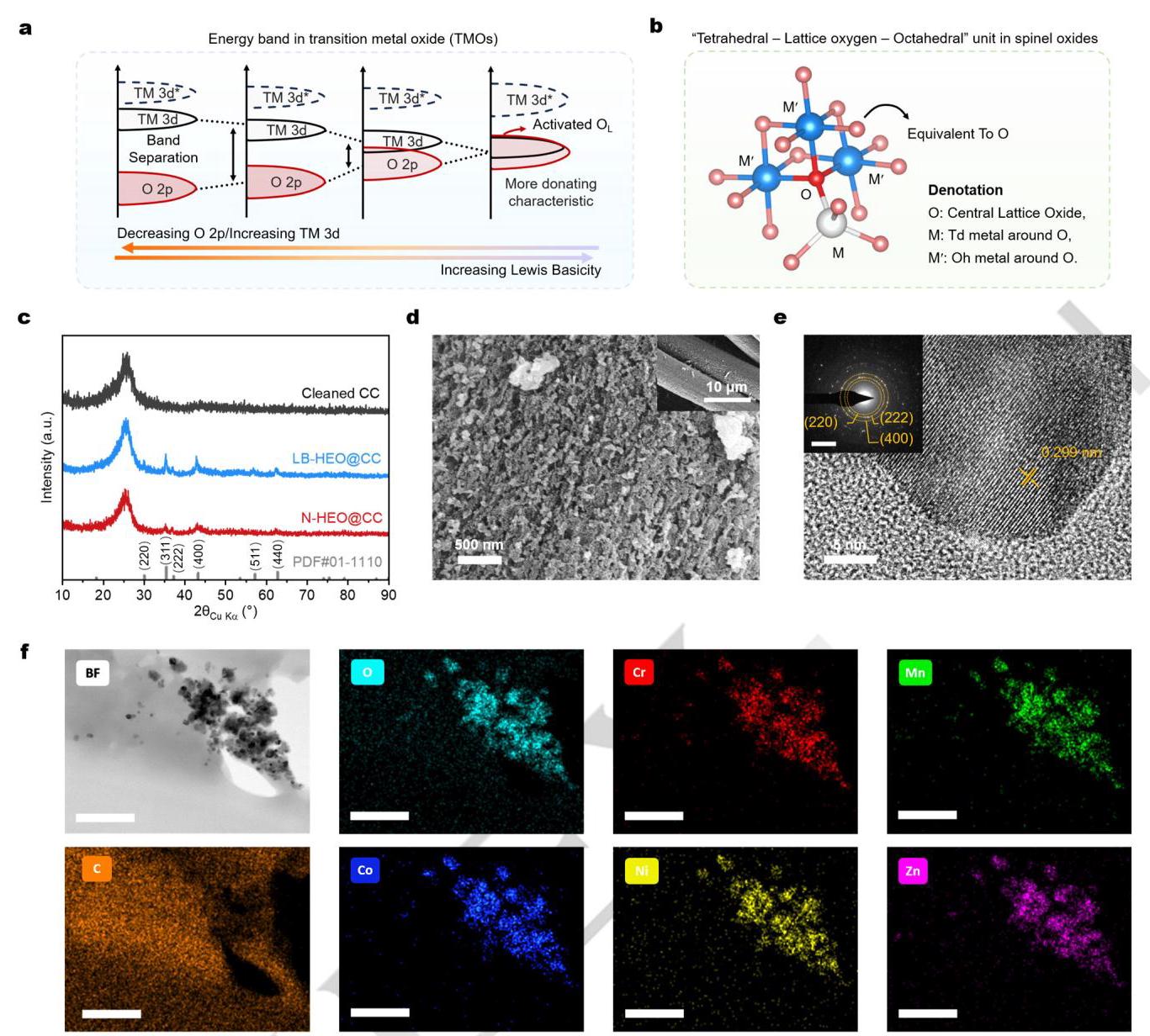
(a) 路易斯碱性与能带理论相关性的示意图解释;(b) 双位点尖晶石氧化物中MTd-OL-MOh单元的示意图;(c) 碳布、LB-HEO和N-HEO的XRD谱图;(d) LB-HEO在碳布上的SEM图像(插图:较低分辨率的SEM图像);(e) LB-HEO的HR-TEM图像(插图:LB-HEO的SAED图案,比例尺为5 nm⁻¹);(f) LB-HEO的EDS mapping,比例尺为200 nm。
结果表明,LB-HEO和N-HEO均呈现单一尖晶石相,粒径小于100 nm的HEOs均匀分布在碳纤维表面。HR-TEM显示清晰的晶格条纹,间距为0.299 nm,对应于尖晶石结构HEO的(220)晶面。EDS mapping显示Cr、Mn、Co、Ni、Zn和O元素在LB-HEO颗粒内均匀分布,这是高熵氧化物的主要特征。
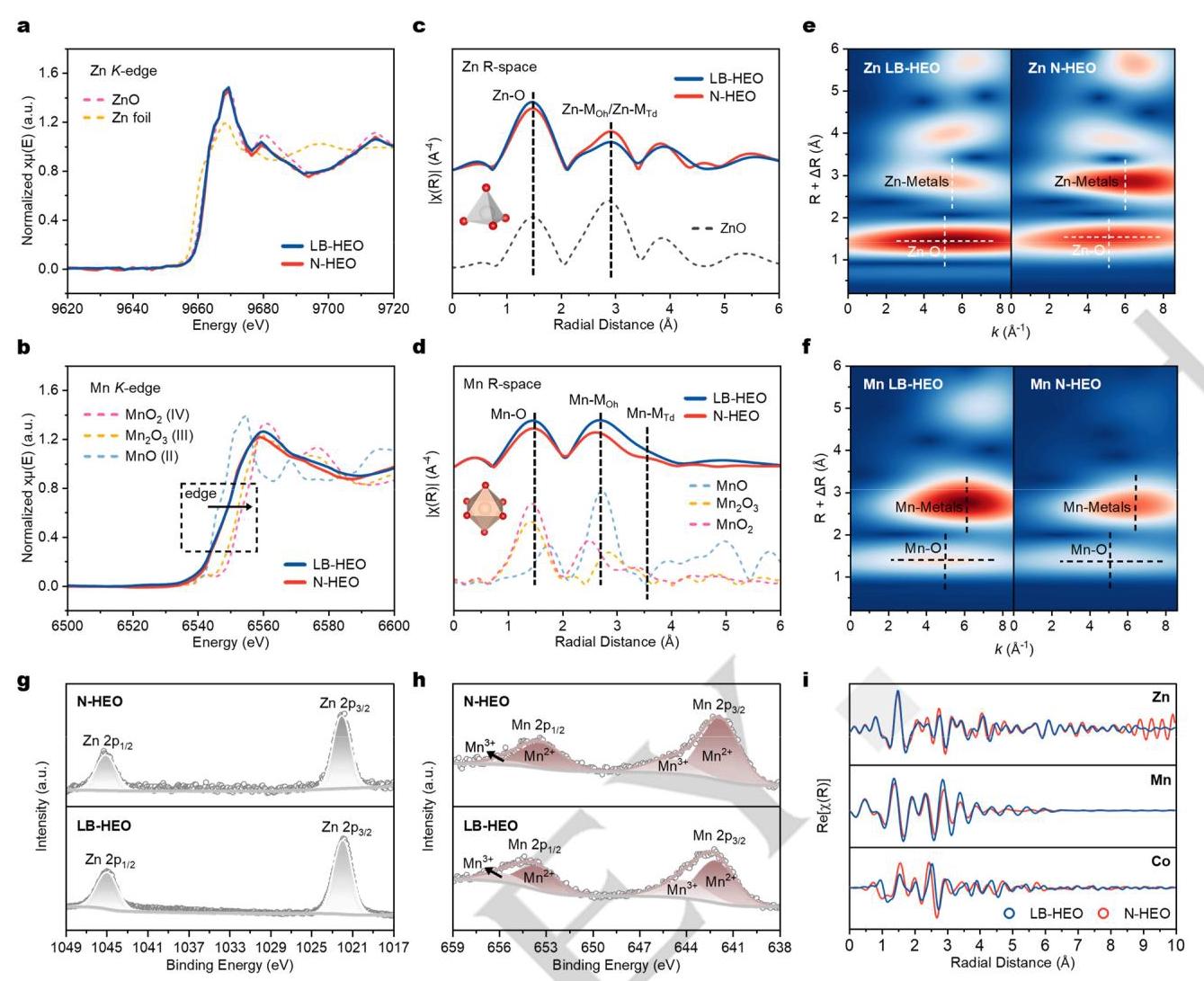
(a) Zn和(b) Mn的归一化K边XANES谱;(c) Zn和(d) Mn的k³加权傅里叶变换EXAFS谱;(e) Zn和(f) Mn的小波变换EXAFS谱;(g) Zn 2p和(h) Mn 2p的XPS谱;(i) 所有傅里叶变换EXAFS谱的实部。
XAFS和XPS分析表明,LB-HEO和N-HEO中Zn的氧化态均为+2,Mn的氧化态介于+2和+3之间。FT-EXAFS证实Zn²⁺位于尖晶石晶格的Td位点,Mn阳离子占据Oh位点。小波变换EXAFS显示LB-HEO中金属-氧键长更短,表明TM 3d带和O 2p带之间有更多重叠,减少了2p带与3d带的分离,使O 2p电子在LB-HEO中表现出更强的电子给予能力。
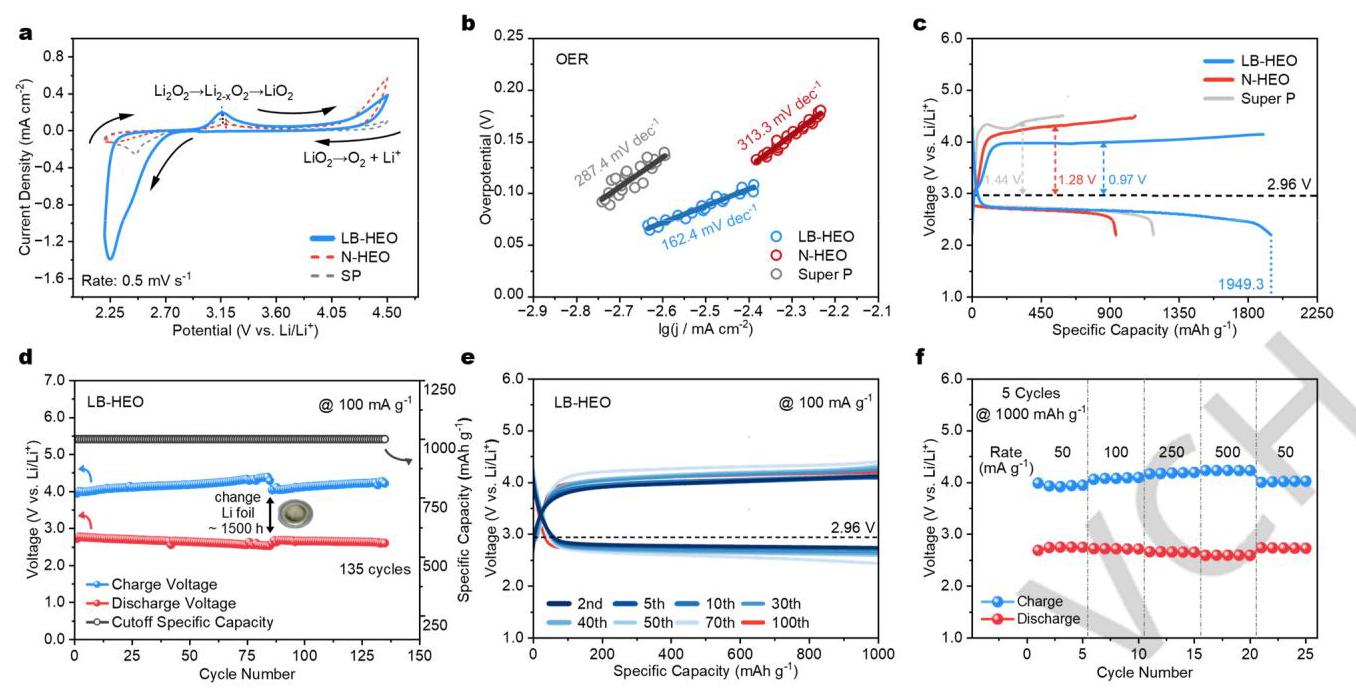
(a) LB-HEO、N-HEO和Super P的CV测试;(b) CV曲线中OER峰的Tafel分析;(c) 不同催化剂正极的LOBs初始全充放电曲线;(d)-(e) 使用LB-HEO的LOBs在100 mA g⁻¹电流密度和1000 mAh g⁻¹容量限制下的循环性能和代表性充放电曲线;(f) 使用LB-HEO催化剂的LOBs倍率性能。
结果表明,使用LB-HEO的电池显示出最高的放电比容量(约2000 mAh g⁻¹)和最低的充电过电位(0.97V)。Tafel斜率分析表明LB-HEO具有更快的OER动力学。循环测试显示LB-HEO基电池可以稳定循环135次,而过电位的增加主要源于锂负极的降解。倍率性能测试表明LB-HEO在不同电流密度下均表现出较低的过电位。
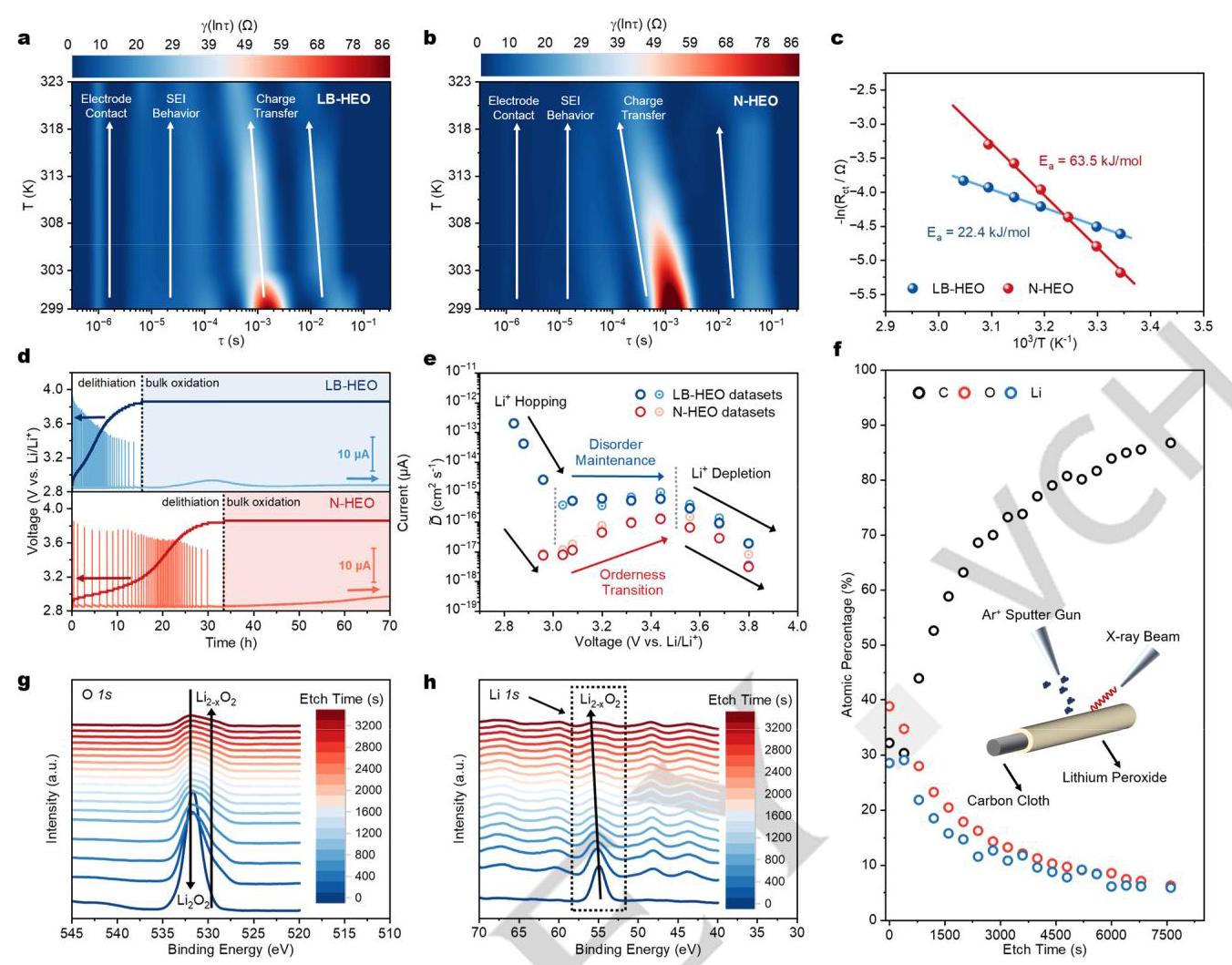
(a) LB-HEO和(b) N-HEO的温度依赖性EIS测试和相关DRT分析;(c) 界面电荷转移电阻的阿伦尼乌斯行为拟合;(d) PITT测试中使用LB-HEO和N-HEO作为催化剂的LOBs电流和电压随充电时间的变化;(e) 不同充电电压下Li⁺的重复化学扩散系数;(f) XPS深度剖析过程中蚀刻化合物的相关原子百分比(插图:深度剖析测试示意图);(g) O 1s和(h) Li 1s XPS深度剖析LB-HEO上放电产物。
DRT分析显示,LB-HEO基电池的界面电荷转移活化能(22.4 kJ mol⁻¹)远低于N-HEO基电池(63.5 kJ mol⁻¹),表明LB-HEO具有更快的界面电荷转移动力学。PITT测试表明,LB-HEO基电池中Li⁺的化学扩散系数比N-HEO基电池高约两个数量级,表明脱锂过程具有更低的活化能和更快的动力学。XPS深度剖析证实了LB-HEO | Li₂O₂界面附近存在更多脱锂物种Li₂₋ₓO₂。
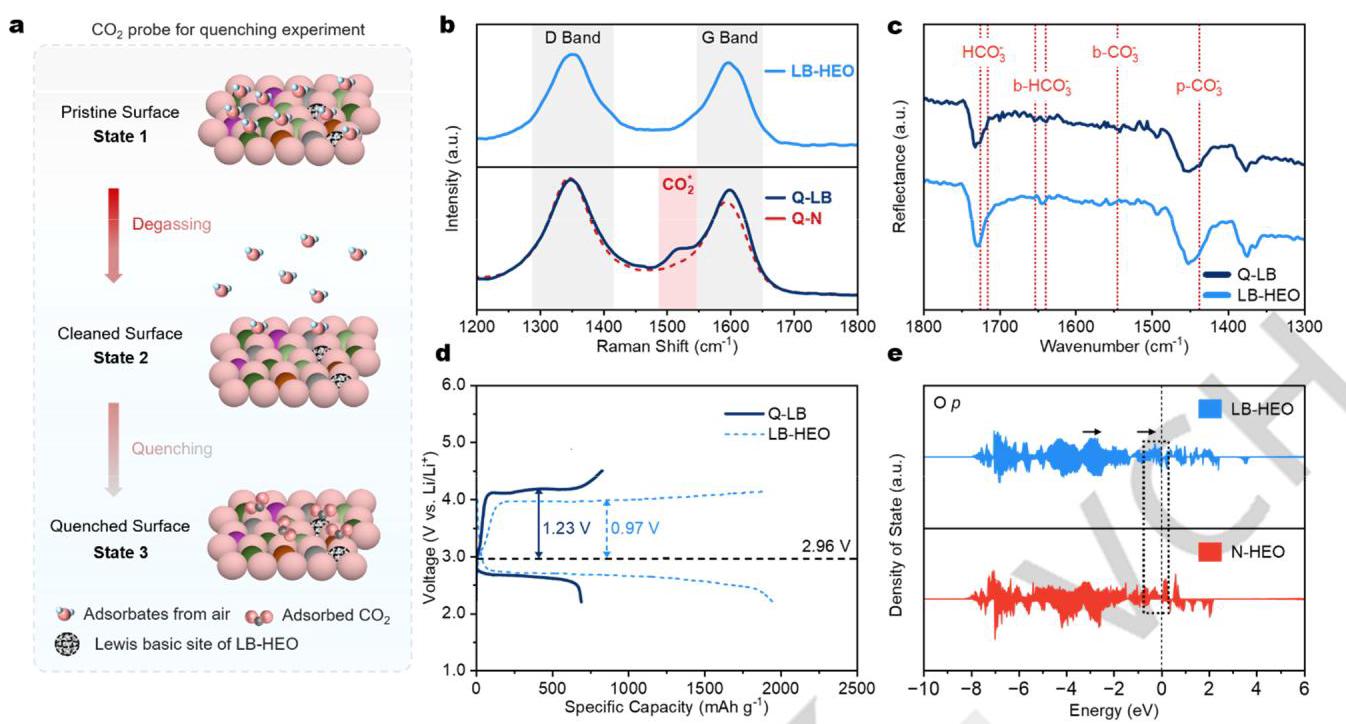
(a) CO₂淬灭过程示意图;(b) LB-HEO、Q-LB和Q-N的拉曼光谱;(c) LB-HEO和Q-LB的FT-IR光谱;(d) 使用LB-HEO和Q-LB作为催化剂的LOBs初始全充放电曲线比较;(e) LB-HEO和N-HEO中氧p带的投影态密度(PDOS)。
CO₂淬灭实验结合拉曼和FT-IR光谱证实了LB-HEO中路易斯碱性的存在。Q-LB的拉曼光谱在1525 cm⁻¹处出现了一个额外的峰,归因于化学吸附的二氧化碳(CO₂*),而Q-N的光谱中没有这个峰。FT-IR光谱提供了OL与CO₂碳位点相互作用的直接证据。电化学测试显示,使用Q-LB正极的电池性能远不如使用原始LB-HEO正极的电池,表明LB-HEO的电化学催化活性与其路易斯碱位点密切相关。DFT计算表明,LB-HEO中O 2p带向费米能级移动,表明晶格氧被激活,表现出更强的电子给予特性和增强的路易斯碱性。