Ultra-fast Joule heating synthesis of homogeneous copper-based bimetallic catalysts for electrochemical nitrate-to-ammonium reduction in wastewater treatment
超快焦耳加热合成均相铜基双金属催化剂用于电化学硝酸盐还原为铵的废水处理
第一作者: Jenn Fang Su (苏仁芳) a,b,c,*
通讯作者: Jenn Fang Su (苏仁芳) a,b,c,*
Minh-Son Hoang (黄民山) a,d, Herma Dina Setiabudi e,f
DOI: 10.1016/j.seppur.2025.133312
PDF原文
期刊: Separation and Purification Technology
发表年份: 2025
论文亮点
- 开发了一种超快速的焦耳加热方法,用于合成一系列均相的铜基双金属催化剂(CuFe、CuNi、CuPd)。
- 均相的CuNi催化剂在电化学硝酸盐还原反应(NO3RR)中表现出卓越的性能,其铵选择性高达98%,产率为49%,形成速率为764 μg h⁻¹ cm⁻²,约为单金属Cu催化剂的两倍。
研究背景
- 氨(NH₃)是现代社会发展至关重要的材料,广泛应用于多个行业,并作为潜在的碳中和能源载体。然而,目前主流的哈伯-博世法合成氨工艺严重依赖化石燃料,且需要高温高压,导致严重的环境污染。
- 电化学合成氨,特别是利用废水中普遍存在的硝酸根离子(NO₃⁻)作为氮源,是一种有前景的替代方法。但该过程涉及复杂的多步质子/电子转移,需要高效的催化剂来控制产物选择性。铜基材料虽显示出潜力,但仍面临催化剂失活、高过电位和氢析出反应竞争等问题。
- 引入第二种金属(如Ni、Fe)可以克服这些问题,通过协同效应和电子结构调控增强性能。然而,传统方法难以合成均相分散的双金属催化剂,尤其是对于存在混溶隙的金属对(如Cu-Ni)。
研究方法
- 催化剂制备: 使用焦耳加热法合成Cu、CuFe、CuNi和CuPd催化剂。将金属盐(CuCl₂, PdCl₂, NiCl₂·6H₂O, FeCl₃·6H₂O)溶解在异丙醇(IPA)中制成0.05 M溶液。对于双金属样品,Cu与其他金属的摩尔比固定为9:1。将前驱体溶液滴加在碳基底(GDL)上,使用可编程电源提供3.2 A的电流脉冲,加热时间超过6秒以确保前驱体完全分解。完成后收集金属粉末并研磨。
- 电极制备: 将3 mg金属粉末与3 μL Nafion和1.14 mL IPA混合,超声30分钟形成分散良好的催化剂浆料。将浆料滴涂在导电基底(GDL)上,负载量达到1 mg cm⁻²。涂层电极在60°C烘箱中干燥,使用前保存在真空干燥器中。
- 材料表征: 使用X射线衍射(XRD)进行物相鉴定;X射线光电子能谱(XPS)分析表面化学性质;扫描电子显微镜(SEM)和高分辨率透射电子显微镜(HR TEM)观察形貌和尺寸;能量色散X射线光谱(EDS)进行元素 mapping 分析。
- 电催化硝酸盐还原: 在H型反应池中使用三电极系统进行。还原池和氧化池用Nafion阳离子交换膜隔开。还原池电解液为0.1 M HClO₄和0.01 M NaNO₃,工作电极为制备的催化剂电极,对电极为铂棒,参比电极为饱和甘汞电极(SCE)。在-0.7 V至-1.0 V (vs. SCE)的不同恒定电位下进行6小时反应。使用离子色谱和紫外/可见光谱法分析NO₃⁻、NO₂⁻和NH₄⁺的浓度变化。
主要结论
- 焦耳加热法成功合成了均相、元素分布均匀的Cu基双金属催化剂(CuFe、CuNi、CuPd),克服了传统方法中金属混溶性的限制。
- 在所有测试的催化剂中,均相CuNi催化剂表现出最优异的电化学硝酸盐还原(NO3RR)性能,其NH₄⁺选择性高达98%,NH₄⁺产率为49%,NH₄⁺形成速率为764 μg h⁻¹ cm⁻²,性能约为单金属Cu催化剂的两倍。
- CuNi的优异性能归因于其增大的电化学活性表面积(ECSA)、Cu和Ni之间的电子重新分布(导致Cu的氧化态降低)以及对中间产物更强的吸附能,从而更倾向于加氢生成NH₄⁺的路径。
催化剂表征结果
图1. CuNi催化剂的合成与表征
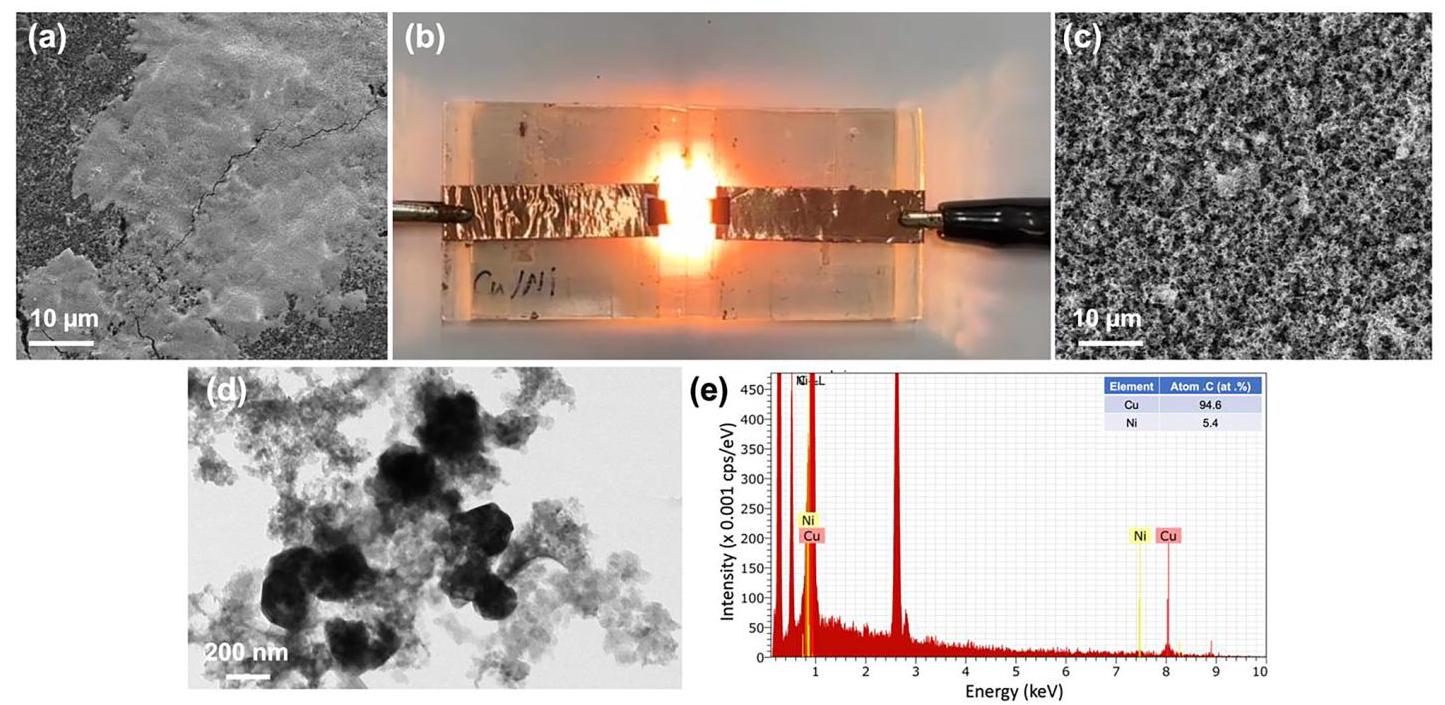
(a) 涂有CuCl₂和NiCl₂盐混合物的GDL碳基底的SEM图像。(b) 焦耳加热过程中的CuCl₂-NiCl₂/GDL图像。(c) 焦耳加热后带有CuNi颗粒的GDL表面SEM图像。(d) 收集的CuNi颗粒的TEM图像。(e) 图1(d)的相应EDS谱图,插图中提供了Cu和Ni的元素比例。
分析结果: 图1展示了通过焦耳加热法合成CuNi催化剂的过程。前驱体盐在GDL上形成白色沉积层(图1a)。焦耳加热时产生强光,表明高温环境(图1b)。加热后白色沉积物消失,形成多孔层和纳米颗粒(图1c, d)。TEM显示颗粒尺寸在100-300 nm,EDS证实了Cu和Ni是主要成分且均匀分布(图1e),成功形成了均相的双金属催化剂。
元素分布分析
图2. 双金属催化剂的SEM图像和EDS元素mapping
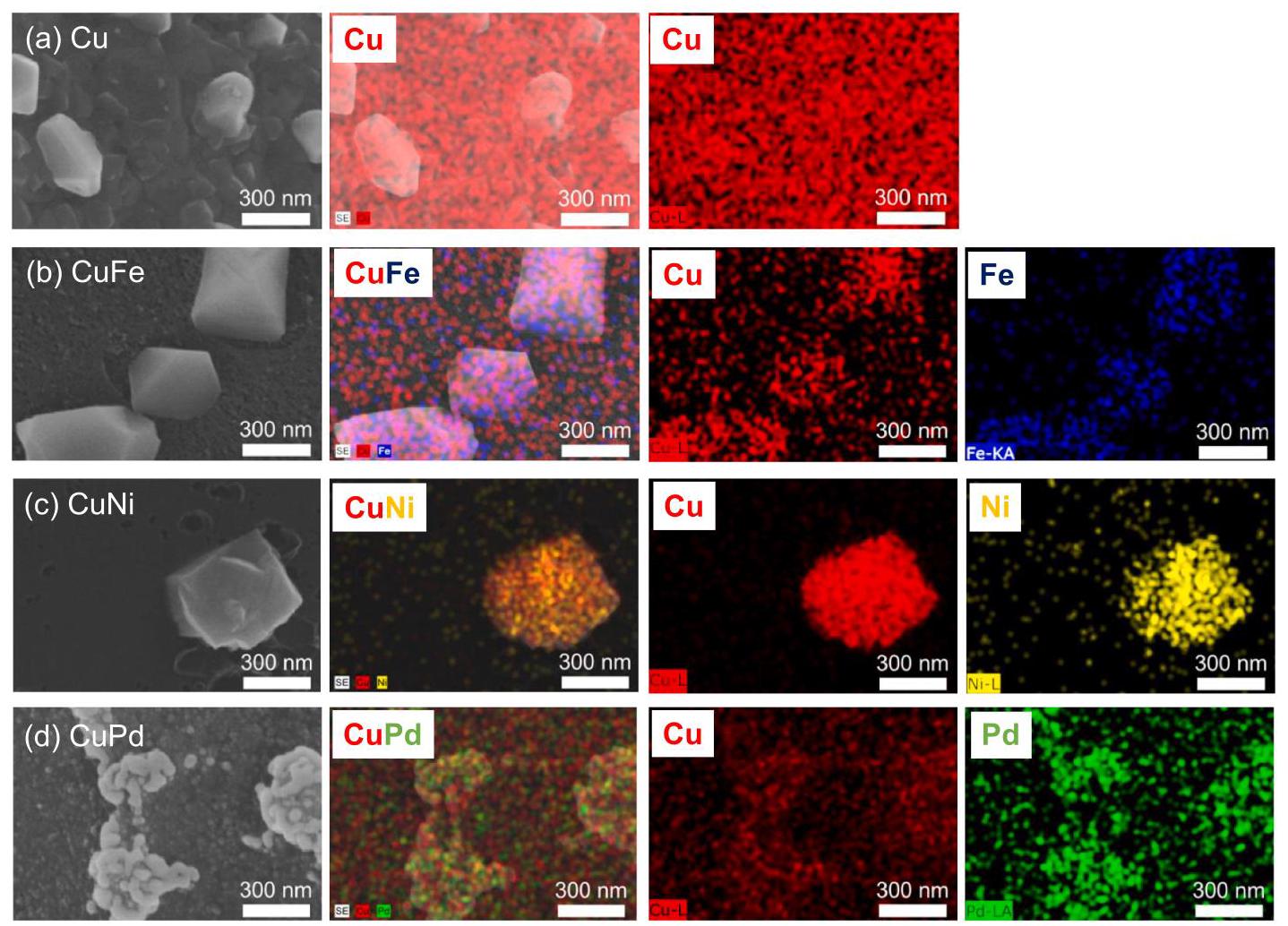
(a) CuFe, (b) CuNi, (c) CuPd, 和 (d) Cu 的SEM图像和相应的EDS元素mapping。所有双金属样品均显示出元素的良好分布。
分析结果: 图2通过SEM和EDS mapping证实了所有通过焦耳加热法合成的双金属催化剂(CuFe, CuNi, CuPd)以及单金属Cu都具有相似的颗粒尺寸(200-400 nm)。更重要的是,元素mapping显示每种元素(Cu, Fe, Ni, Pd)在双金属颗粒中都均匀分布,没有出现相分离成单独金属相的情况。这证明了焦耳加热法有效促进了金属间的混合,成功合成了均相的双金属颗粒,克服了Cu与Ni、Fe等金属在热力学上的不混溶性。
晶体结构与表面化学分析
图3. 不同金属催化剂的XRD图谱
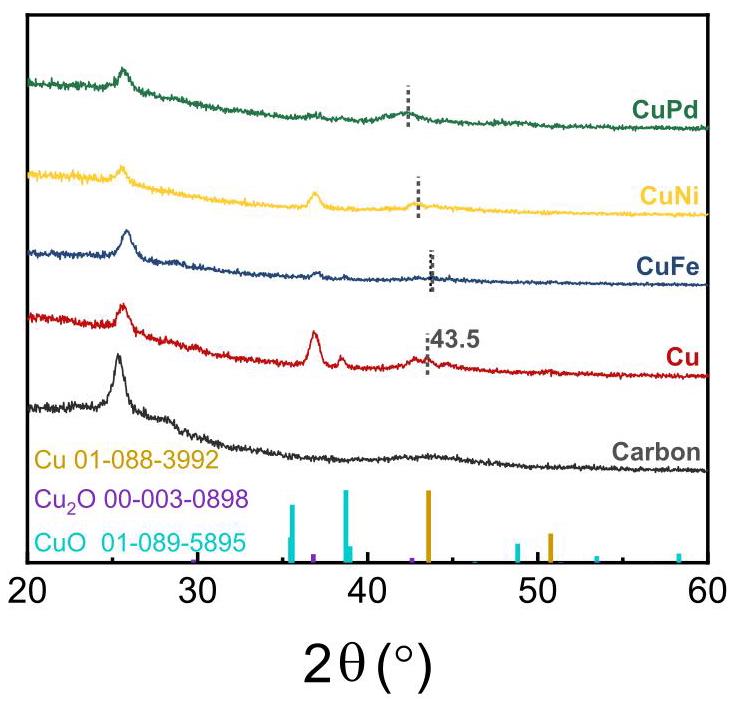
焦耳加热过程后各种金属催化剂的XRD图谱。
分析结果: XRD图谱显示所有样品在26.2°都有一个相同的峰,对应于石墨碳基底。在35°到40°范围内的主峰归因于环境条件下金属颗粒的氧化。在43.5°附近的一个小峰对应于金属Cu的(111)晶面。双金属样品在43.5°附近的衍射峰有轻微偏移(图3和图S6中的灰色虚线突出显示),这表明第二种金属(Ni, Fe, Pd)成功地掺入了Cu晶格中。没有出现对应于这些次要金属的附加峰,进一步验证了它们没有偏析形成单独的相,而是很好地分布在Cu晶格内,这与图2的EDS结果一致。
图4. 不同样品的XPS光谱
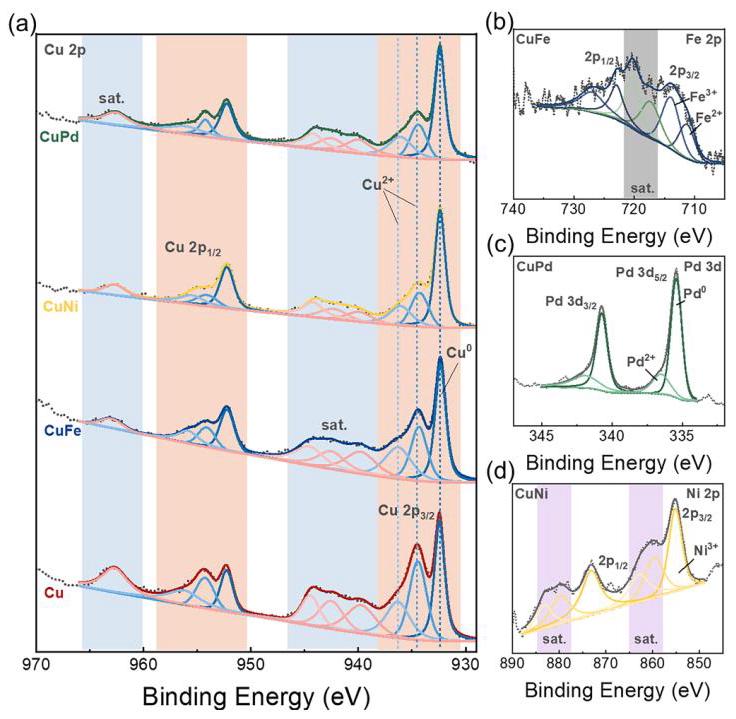
(a) 4个样品的XPS Cu 2p光谱。(b) CuFe的Fe 2p光谱。(c) CuPd的Pd 3d光谱。(d) CuNi的Ni 2p光谱。
分析结果: XPS分析揭示了催化剂的表面化学状态和电子结构。Cu 2p光谱(图4a)显示,将其他金属掺入Cu会导致主峰(~932.5 eV,对应Cu⁰或Cu⁺)发生轻微的蓝移(尤其是在CuFe和CuNi样品中),这归因于材料内部的电子重新分布。与Cu²⁺相关的卫星峰信号强度在Cu样品中最高,在双金属样品中逐渐降低,在CuNi样品中强度最低,表明第二种金属的加入限制了双金属样品中Cu的氧化。CuFe、CuPd和CuNi样品的相应元素光谱(图4b-d)均确认了第二种金属的存在及其氧化状态(如Fe²⁺/Fe³⁺, Pd⁰/Pd²⁺, Ni³⁺),证明了双金属结构的形成。
电化学活性表面积分析
图5. 双电层电容
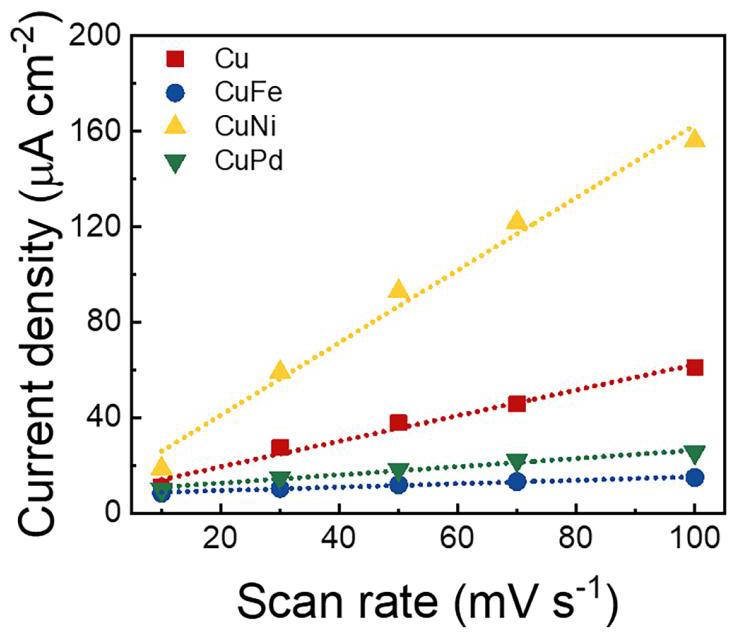
Cu、CuFe、CuNi和CuPd催化剂的双电层电容。
分析结果: 通过循环伏安法(CV)测量非法拉第区的双电层电容(Cdl)来评估电化学活性表面积(ECSA)。图5显示了电流密度差值相对于扫描速率的图,其斜率即为Cdl。如表1所示,CuNi催化剂的Cdl值最高(1.518 mF cm⁻²),计算出的ECSA也最大(38.0),远高于Cu(13.4)、CuFe(1.80)和CuPd(4.30)样品。这表明CuNi催化剂表面具有更高密度的电化学活性位点,揭示了其在NO3RR中具有增强催化活性的潜力。
硝酸盐还原反应性能
图6. 不同金属催化剂的NO3RR性能
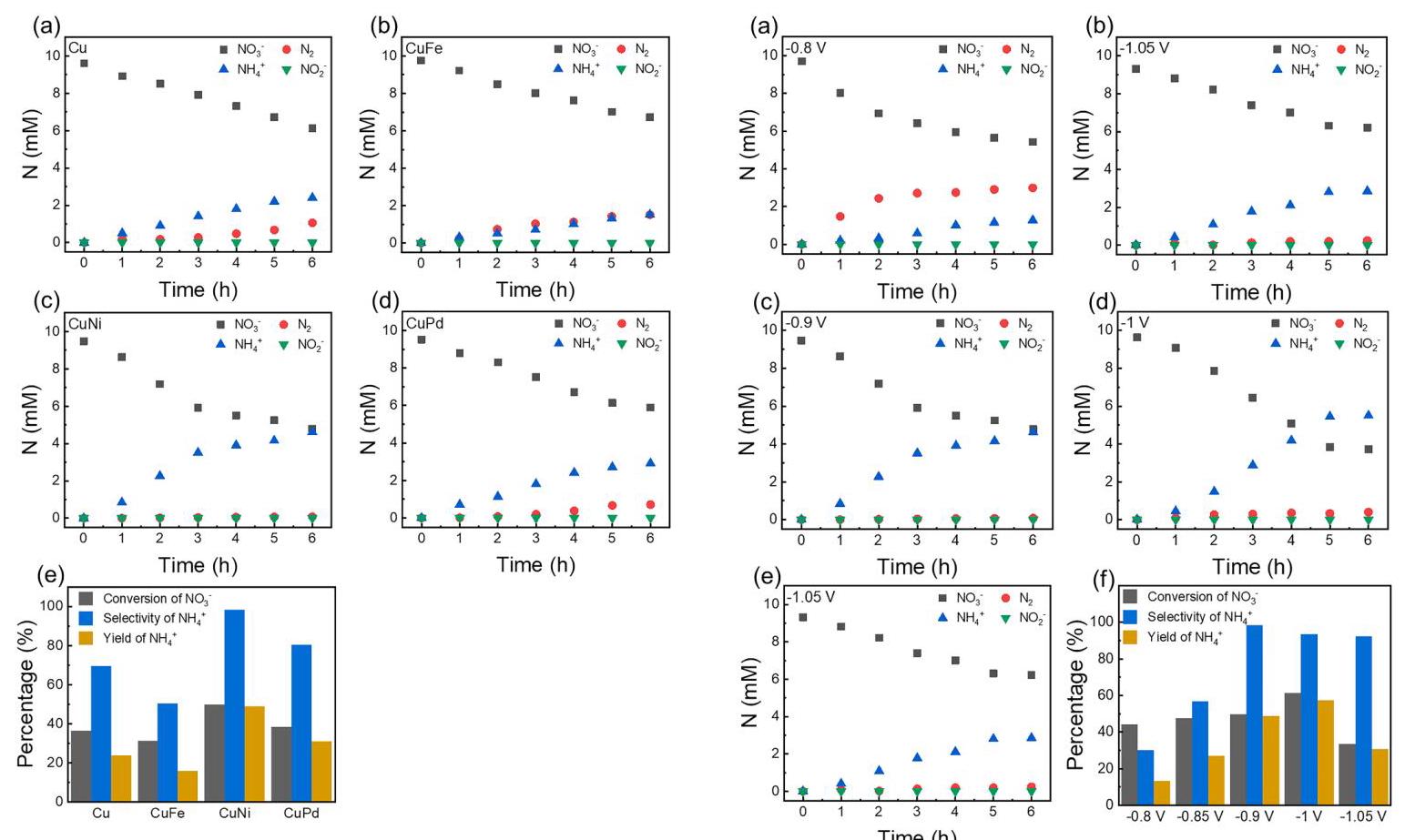
(a) Cu, (b) CuFe, (c) CuNi, 和 (d) CuPd的NO3RR性能。(e) NO₃⁻转化率、NH₄⁺选择性和NH₄⁺产率的比较。
分析结果: 图6展示了不同催化剂在-0.9 V (vs. SCE)下的NO3RR性能。在所有情况下,几乎检测不到NO₂⁻,表明中间产物转化迅速。NO₃⁻浓度随时间下降,同时伴随N₂和NH₄⁺的生成。性能总结于图6e和表S2,CuNi催化剂表现出最优异的还原性能:NO₃⁻转化率(50%)、NH₄⁺选择性(98%)和NH₄⁺产率(49%)均最高,分别是Cu单金属催化剂的约2倍、1.5倍和2倍。这种优异的性能归因于Ni的引入带来的电子效应和其本身较低的还原电位,有利于维持稳定的反应电流和增强中间产物的吸附,从而更倾向于加氢生成NH₄⁺的路径。
CuNi催化剂在不同电位下的性能
图7. 不同电位下CuNi催化剂的N物种浓度分布

(a) -0.8 V, (b) -0.85 V, (c) -0.9 V, (d) -1.0 V, 和 (e) -1.05 V (vs. SCE)下的浓度分布。(f) 还原性能总结。
分析结果: 图7研究了均相CuNi催化剂在不同还原电位(-0.8 V 至 -1.05 V vs. SCE)下的NO3RR性能。随着施加电位变得更负,反应电流密度显著增加。NO₃⁻浓度逐渐降低且未检测到NO₂⁻形成,NH₄⁺产量在电位从-0.8 V移至-1.0 V时稳步增加,但在-1.05 V时急剧下降,这可能是由于竞争性的氢析出反应(HER)加剧所致。在-1.0 V时获得最高的NO₃⁻转化率(61%)和NH₄⁺产率(57%),而在-0.9 V时获得最高的NH₄⁺选择性(98%)、最高的NH₄⁺法拉第效率(40%)和最高的NH₄⁺形成速率(764 μg h⁻¹ cm⁻²)。这表明在超过-0.9 V的更负电位下,质子与NO₃⁻的竞争吸附开始影响还原性能。CuNi催化剂在-0.9 V下的选择性超过了以往许多研究中报道的性能。





