图1: FJH合成金属硼化物示意图及晶体结构
分析结果
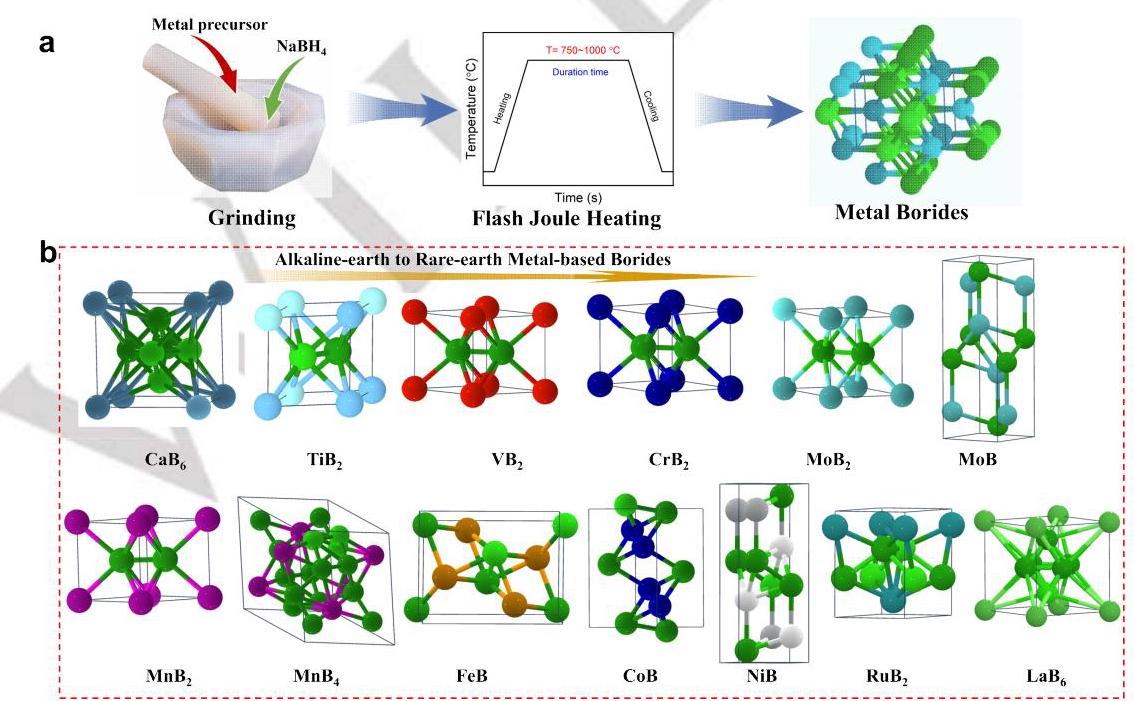
图1a展示了FJH技术合成金属硼化物的过程示意图,通过毫秒级电流脉冲实现超快速加热和冷却,有效防止了颗粒烧结和团聚。图1b展示了合成的多种金属硼化物的晶体结构,证明了FJH技术的广泛适用性,能够合成从碱土金属到稀土金属的各种硼化物。
第一作者: Tingting Liu (刘婷婷)
通讯作者: Zonghua Pu (蒲宗华), Qiufeng Huang (黄秋风), Min Han (韩敏), Qingjun Chen (陈庆军), Shichun Mu (木士春)
所属机构: 福建师范大学, 南京师范大学, 中国科学院赣江创新研究院, 沙特国王大学, 武汉理工大学
开发了一种超快闪速焦耳加热(FJH)技术,可在60秒内合成多种纳米级金属硼化物,包括碱土金属、过渡金属、贵金属和稀土金属硼化物。
合成的RuB₂表现出卓越的电催化析氢反应(HER)性能,在酸性条件下仅需15mV过电位即可达到10mA cm⁻²的电流密度,并具有近100%的法拉第效率。
使用毫秒级电流脉冲对前体进行快速加热,使样品温度迅速升至超高水平(>3000K),随后以超过10⁴K s⁻¹的速率快速冷却至室温。这种快速温度波动使反应在几秒钟内完成,同时防止了长时间热处理导致的活性组分烧结和团聚。
FJH技术成功合成了15种重要的金属硼化物,包括碱土金属硼化物(CaB₆)、过渡金属硼化物(TiB₂、VB₂、CrB₂等)、贵金属硼化物(RuB₂、RuB₁.₁)和稀土金属硼化物(LaB₆、CeB₆)。
RuB₂表现出优异的HER电催化性能,在酸性条件下仅需15mV过电位即可达到10mA cm⁻²的电流密度,性能优于商业Pt/C催化剂。
通过优化电解液微环境(调控H⁺和K⁺浓度)可显著增强RuB₂的催化稳定性,实验和DFT计算表明RuB₂周围局部存在的H⁺和K⁺对其稳定性增强起关键作用。

图1a展示了FJH技术合成金属硼化物的过程示意图,通过毫秒级电流脉冲实现超快速加热和冷却,有效防止了颗粒烧结和团聚。图1b展示了合成的多种金属硼化物的晶体结构,证明了FJH技术的广泛适用性,能够合成从碱土金属到稀土金属的各种硼化物。
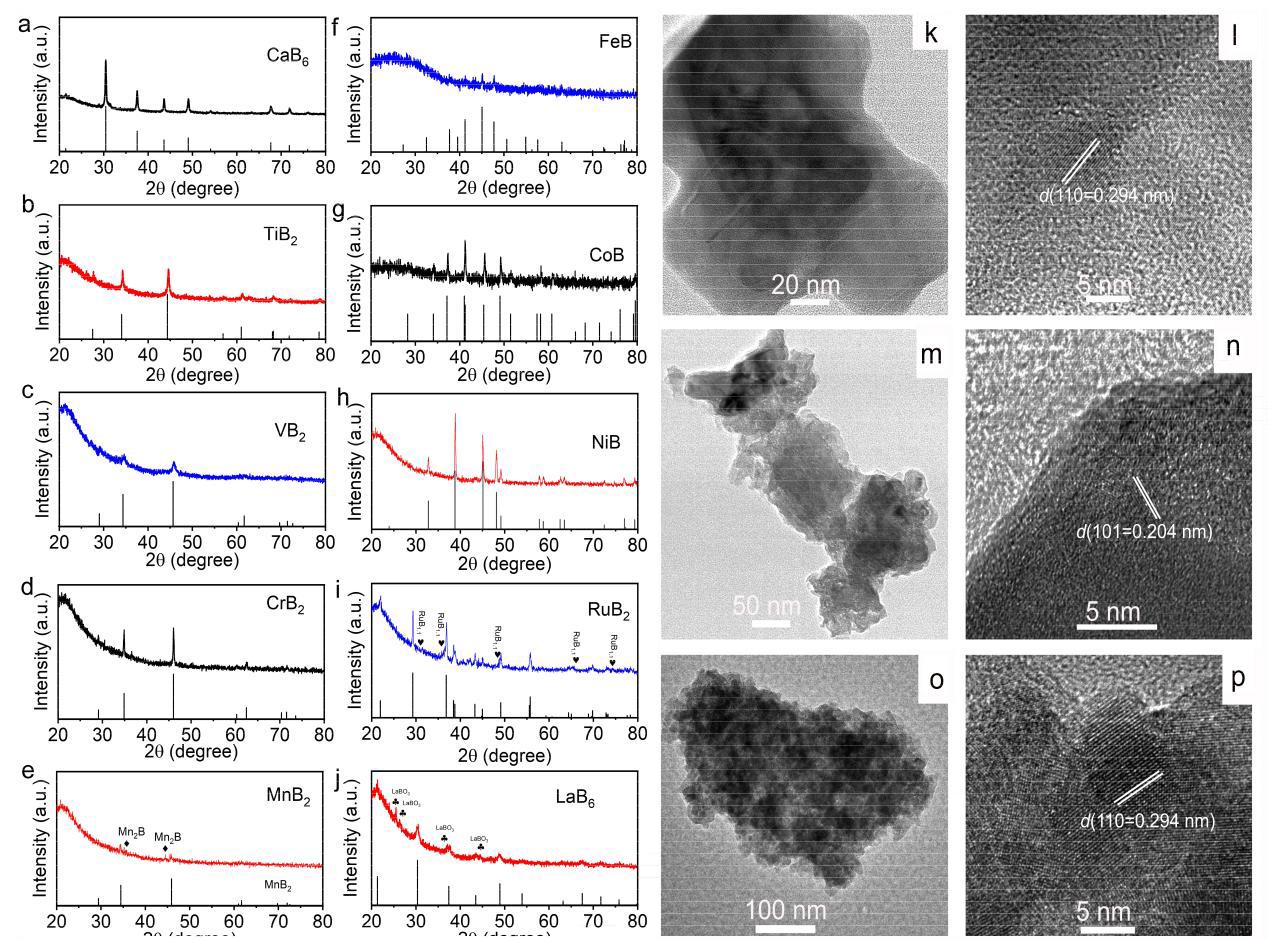
图2a-j展示了十种不同金属硼化物的XRD谱图,与标准PDF卡片吻合良好,证明了合成产物的高结晶度和相纯度。图2k-p的TEM和HRTEM图像显示,合成的硼化物具有纳米尺度的形貌,其中CaB₆、TiB₂和LaB₆呈现典型的纳米片结构,而VB₂和CrB₂则由小纳米颗粒组成。HRTEM图像显示清晰的晶格条纹,证明了材料的良好结晶性。
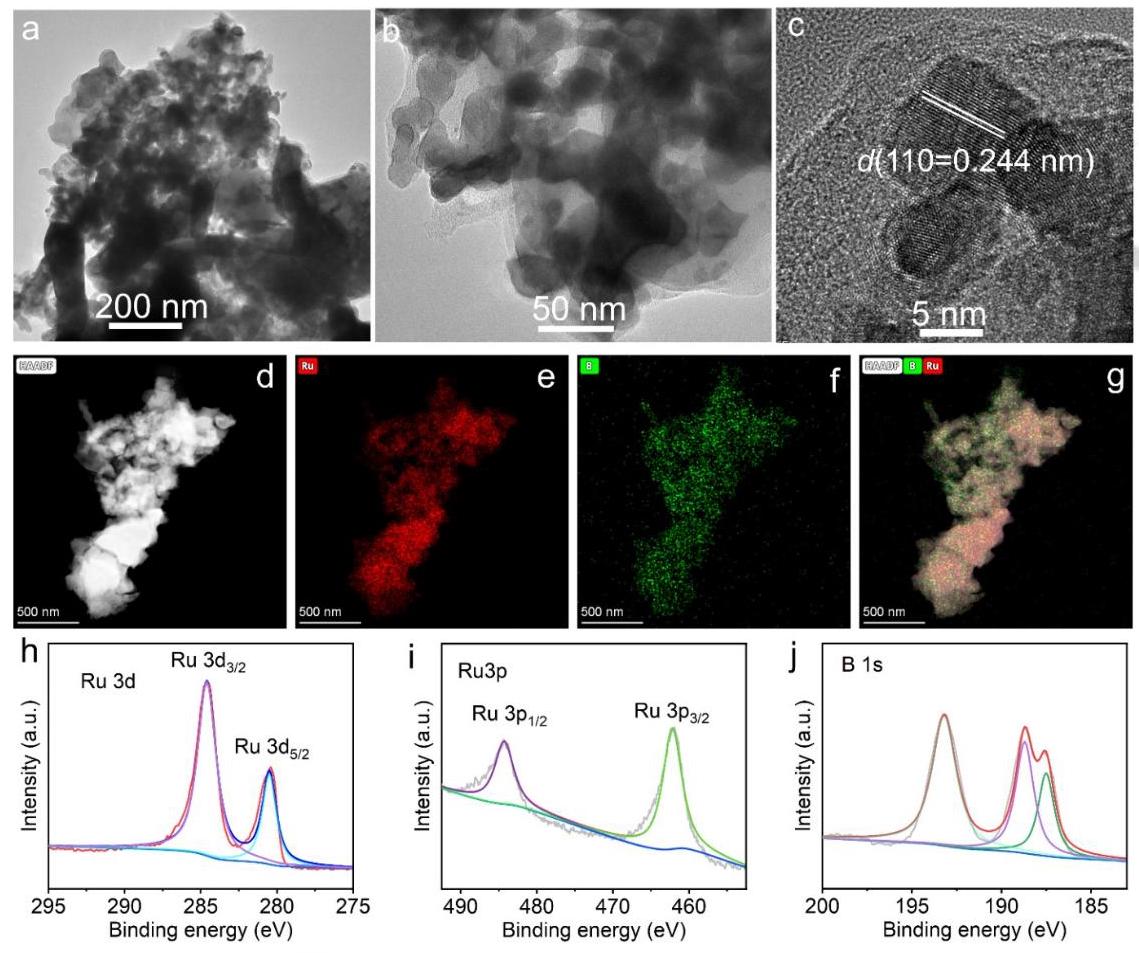
图3a-b的TEM图像显示FJH合成的RuB₂由大量纳米颗粒组成,粒径范围为5-200nm,远小于传统方法合成的块状RuB₂颗粒(>100nm)。图3c的HRTEM图像显示0.244nm的清晰晶格条纹,对应于正交相RuB₂的(110)晶面。图3d-g的HAADF-STEM和EDS元素映射显示Ru和B元素在纳米颗粒中均匀分布。XPS分析(图3h-j)进一步证实了RuB₂的成功合成,显示了Ru-B键的特征峰。
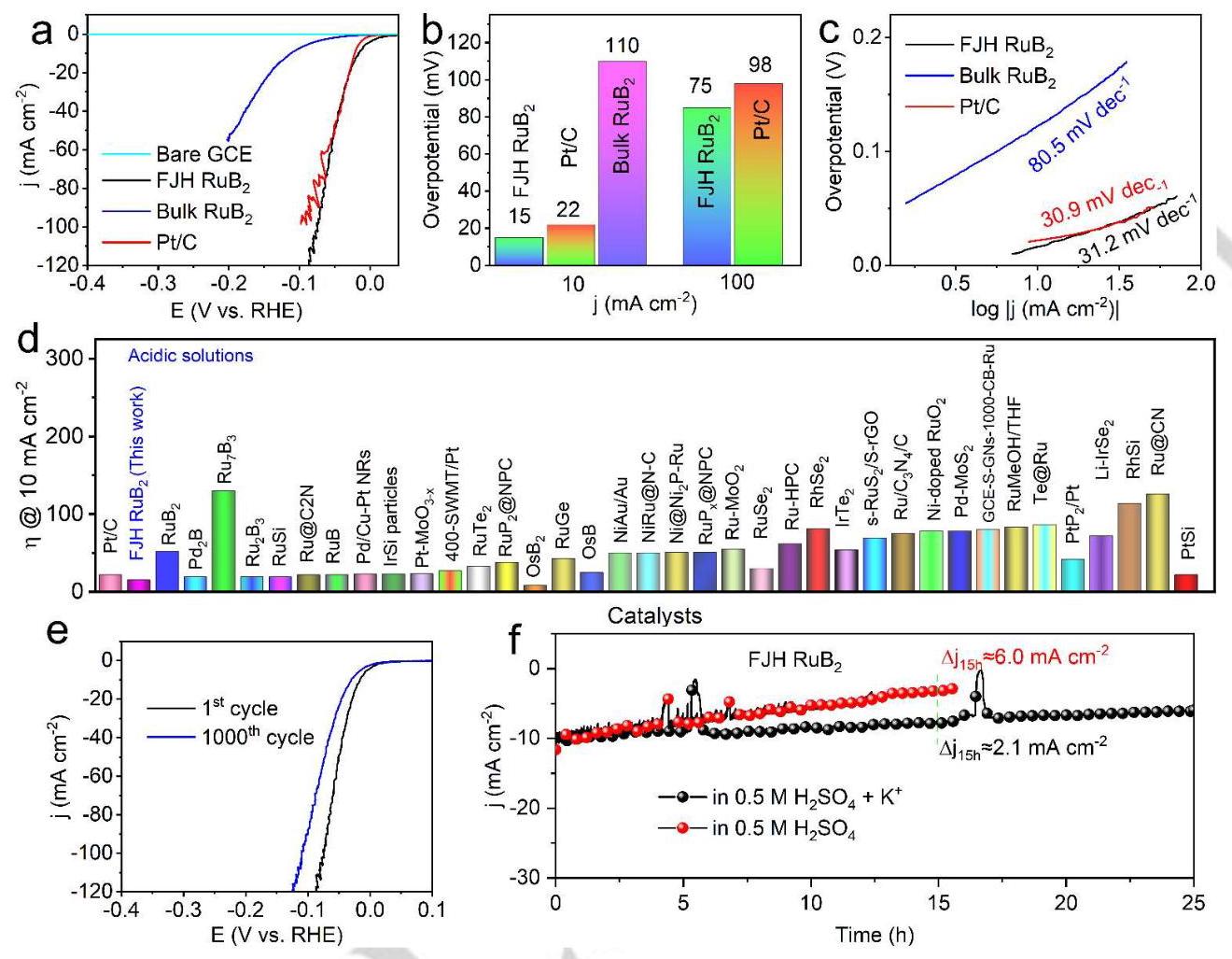
图4a显示FJH RuB₂在酸性条件下的HER性能优于块状RuB₂和商业Pt/C催化剂,仅需15mV过电位即可达到10mA cm⁻²的电流密度。图4b进一步量化比较了不同催化剂的过电位,证明FJH RuB₂的卓越性能。图4c的Tafel斜率分析表明FJH RuB₂具有更快的HER动力学。图4d显示FJH RuB₂的性能优于大多数已报道的贵金属基HER催化剂。稳定性测试(图4e-f)表明FJH RuB₂具有良好的稳定性,且通过引入K⁺可以进一步显著增强其稳定性。
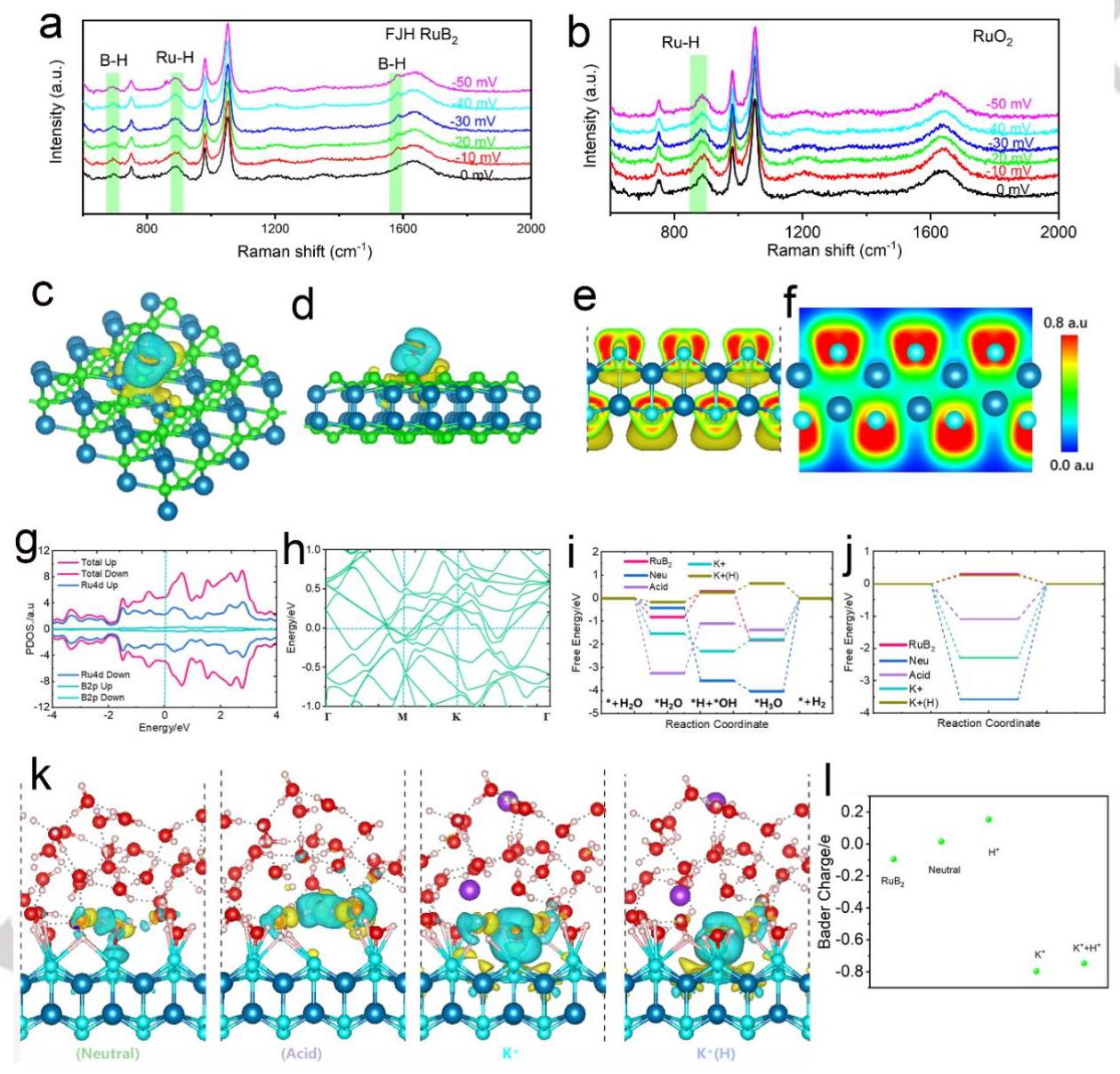
图5a-b的原位拉曼光谱表明,在HER催化过程中,FJH RuB₂同时存在Ru-H和B-H键的振动峰,证明Ru和B位点都是HER的活性位点。图5c-f的电荷密度差和电子定位函数分析证实了电子从Ru原子向B原子的转移。图5g-h的PDOS和能带结构显示RuB₂的导带被费米能级穿越,表明具有显著的电子迁移率,且不存在带隙,这对电催化HER非常重要。图5i-j的自由能图显示在H⁺和K⁺共存的微环境中,FJH RuB₂具有接近零的ΔG_H*值,表明在此环境下具有优化的HER催化活性。图5k-l的DFT计算表明,在酸性溶液微环境中引入K⁺后,催化剂上的Bader电荷减少了约0.89|e|,表明添加的阳离子通过电场效应影响催化剂表面,导致水合氢离子迁移速率适度降低,从而增强了催化剂的稳定性。