Ru-doped Bi₂O₃ with rich oxygen vacancy for enhanced photocatalytic nitrogen reduction
基于富氧空位的Ru掺杂Bi₂O₃用于增强光催化氮还原
第一作者: Qianyu Chu (中国海洋大学)
通讯作者: Guangming Ren (中国海洋大学, 青岛科技大学), Xiangchao Meng (中国海洋大学)
DOI: https://doi.org/10.1016/j.jallcom.2024.178441
PDF原文
期刊: Journal of Alloys and Compounds
发表年份: 2025
图1: Bi₂O₃和Ru-Bi₂O₃的形貌表征

图1. (a-b) Bi₂O₃和Ru-Bi₂O₃的SEM图像, (c-d) Ru-Bi₂O₃的TEM和HRTEM图像
内容描述: 图1展示了Bi₂O₃和Ru-Bi₂O₃催化剂的形貌特征。从SEM图像(图1a-b)可以看出,Bi₂O₃呈现由薄片组成的花状结构,尺寸约为1-2μm,表面粗糙致密。Ru-Bi₂O₃的形貌与Bi₂O₃相似,均为不规则纳米花簇状结构。TEM和HRTEM图像(图1c-d)显示,Ru-Bi₂O₃的晶格条纹中间出现显著模糊和无序,表明快速焦耳加热处理破坏了表面结构,形成了表面氧空位。测量的0.31 nm晶格间距对应于Ru-Bi₂O₃的(121)晶面,与XRD结果一致。
分析结果: 快速焦耳加热法避免了结构坍塌和聚集过程,形成了粗糙致密的表面结构。Ru掺杂和高温处理导致晶格畸变和缺陷形成,为催化反应提供了丰富的活性位点。HRTEM中观察到的晶格无序证实了表面氧空位的形成,这有助于光生载流子的分离和氮分子的吸附。
图2: Bi₂O₃和Ru-Bi₂O₃的结构表征
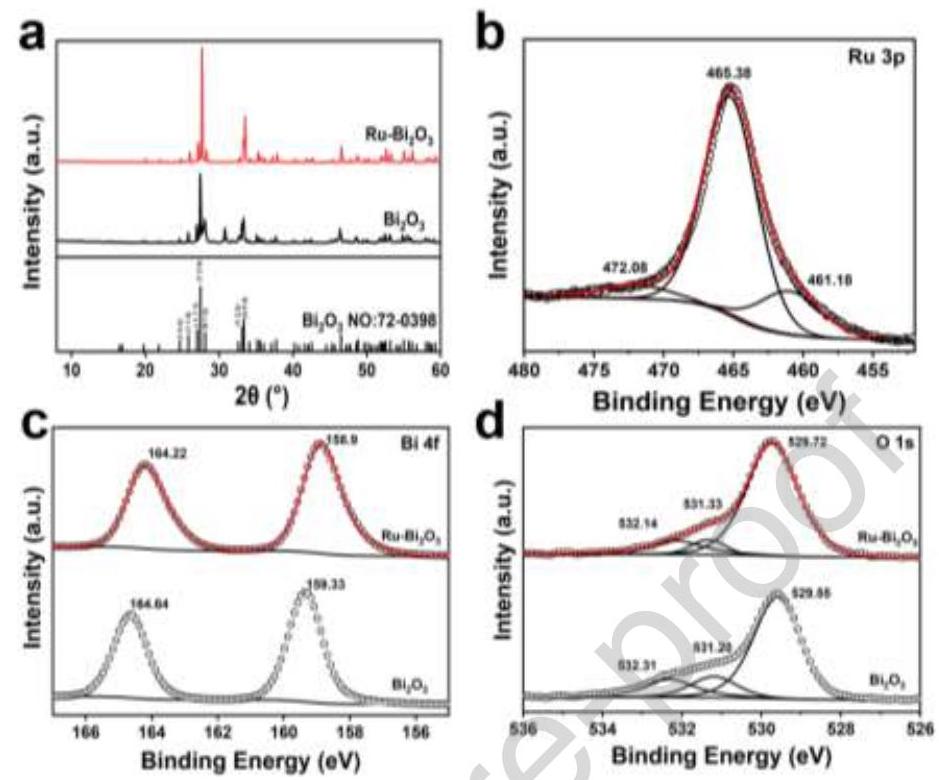
图2. (a) Bi₂O₃和Ru-Bi₂O₃的XRD图谱, (b) Ru 3p, (c) Bi 4f, (d) O 1s的XPS谱图
内容描述: 图2展示了Bi₂O₃和Ru-Bi₂O₃的结构和化学状态表征结果。XRD图谱(图2a)显示,所有特征峰均对应于Bi₂O₃(JCPDS No. 72-0398),Ru掺杂后27.5°处的衍射峰向更大角度移动了0.21°,表明晶面间距减小。XPS分析表明,Ru-Bi₂O₃表面存在Bi、Ru和O元素以及无定形碳。Ru 3p谱(图2b)显示在465.38 eV和461.18 eV处的峰分别对应Ru⁴⁺和Ru⁰。Bi 4f谱(图2c)中,Bi₂O₃在158.75 eV和164.06 eV处有双峰对应Bi³⁺,Ru掺杂后结合能降低。O 1s谱(图2d)可分解为晶格氧(529.55 eV)、氧空位(531.20 eV)和表面化学吸附氧(532.31 eV)。
分析结果: XRD中衍射峰的位移表明Ru成功掺杂到Bi₂O₃晶格中,由于Ru离子半径(0.62Å)小于Bi离子半径(1.03Å),导致Bi₂O₃晶格收缩。XPS结果证实了Ru⁰和Ru⁴⁺的存在,表明在H₂/Ar还原气氛中部分Ru被还原。Bi 4f结合能的降低表明Ru掺杂改变了Bi₂O₃的电子结构。O 1s谱中晶格氧和氧空位峰的红移表明晶格畸变,验证了氧空位的形成。这些结果共同表明高温快速热处理对调节氧物种和金属组织有显著影响。
图3: 光催化固氮性能测试
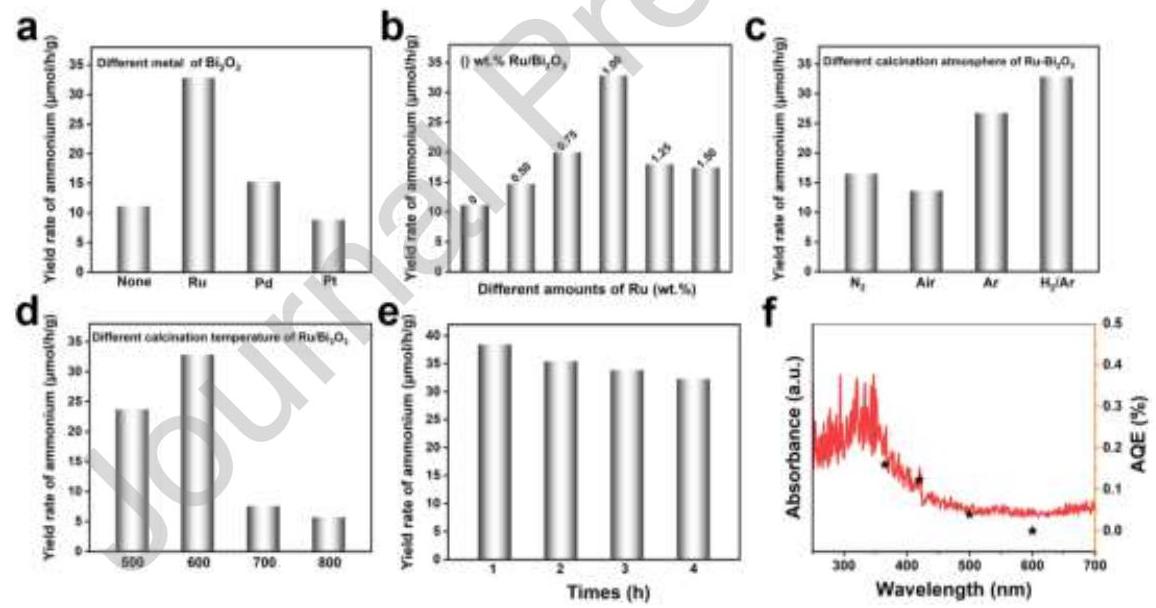
图3. (a) 不同金属掺杂催化剂的固氮性能, (b) 不同Ru负载量的Bi₂O₃, (c) 不同气氛下的Ru-Bi₂O₃, (d) 不同煅烧温度的Ru-Bi₂O₃, (e) Ru-Bi₂O₃的光催化循环测试, (f) Ru-Bi₂O₃上固氮产率的AQE(黑点)及其光吸收谱(红线)
内容描述: 图3系统评估了催化剂的光催化固氮性能。Ru掺杂使Bi₂O₃的氨合成速率从11.1 μmol g⁻¹ h⁻¹提高到32.9 μmol g⁻¹ h⁻¹(图3a)。1.0 wt% Ru掺杂的催化剂在H₂/Ar气氛下表现出最佳活性(图3b)。与其他金属(Pd, Pt)掺杂相比,Ru-Bi₂O₃的固氮活性显著更高(图3c)。H₂/Ar还原气氛下制备的催化剂性能最佳(图3d)。循环测试表明Ru-Bi₂O₃具有良好的稳定性(图3e)。表观量子效率(AQE)随单色光波长增加而降低,与DRS测试的光响应性匹配良好(图3f)。
分析结果: Ru掺杂显著提高了Bi₂O₃的光催化固氮性能,这归因于Ru抑制了光生电子-空穴复合率,提高了光催化性能。Ru作为电子受体和给体与Bi₂O₃表面不饱和位点的协同作用促进了NRR的发生。过量Ru会饱和表面活性位点,阻塞反应位点,降低光催化性能。H₂/Ar还原气氛能有效加速Ru的还原,增强金属-载体相互作用(MSI)。600°C下制备的催化剂具有最高氨合成速率,过高温度会导致催化剂表面缺陷过多,活性位点破裂。Ru-Bi₂O₃具有良好的可重复使用性和稳定性,经过4小时测试未观察到显著失活。
图4: 光学和电学性质
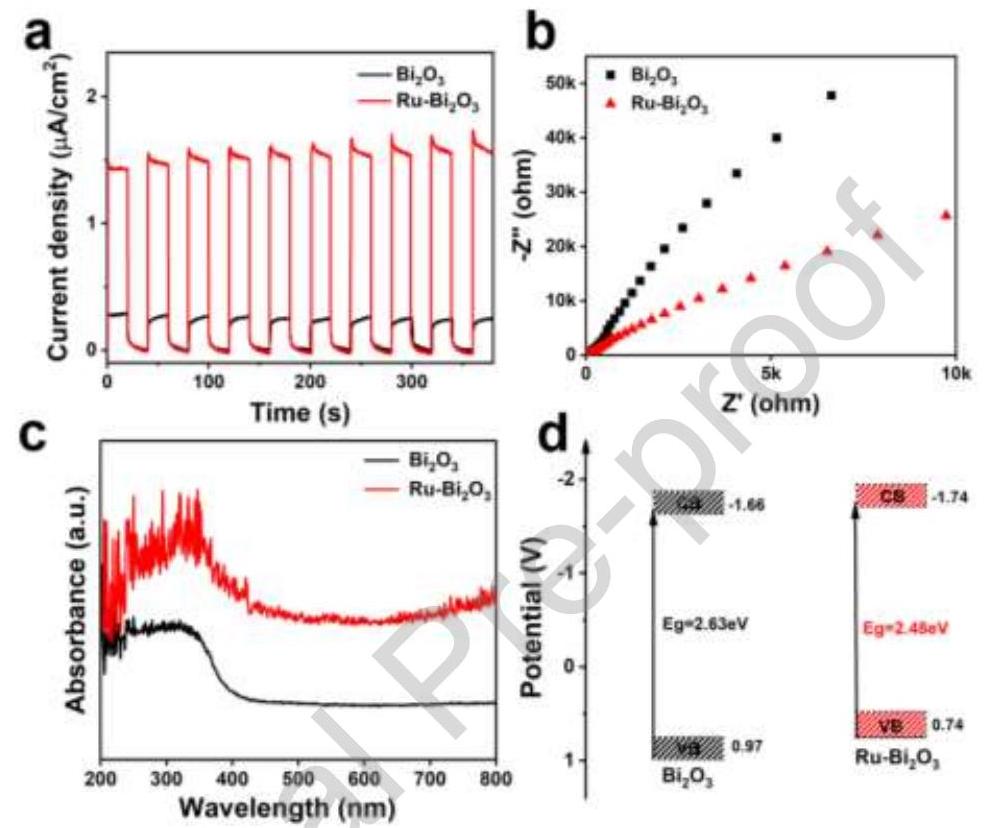
图4. (a) 光电流响应, (b) EIS谱, (c) DRS谱, (d) Bi₂O₃和Ru-Bi₂O₃的能带结构示意图
内容描述: 图4展示了催化剂的光学和电学性质。光电流响应测试(图4a)显示,光照下光电流密度明显高于黑暗条件,Ru-Bi₂O₃的光电流响应远高于Bi₂O₃。EIS谱(图4b)表明,Ru-Bi₂O₃的弧半径远小于Bi₂O₃,表明其电荷传输阻力更小。UV-vis DRS谱(图4c)显示,Ru-Bi₂O₃的光吸收范围变宽,在可见光区有明显的等离子体共振吸收。能带结构示意图(图4d)显示,Bi₂O₃和Ru-Bi₂O₃的带隙分别为2.63 eV和2.38 eV,导带位置分别为-1.54 eV和-1.66 eV。
分析结果: Ru-Bi₂O₃较高的光电流响应表明其光生载流子复合率低,界面传输速率快,光生电子-空穴对寿命显著增强。较小的EIS弧半径表明Ru-Bi₂O₃具有更高的界面电荷传输能力和更低的光生载流子复合率,这有利于光催化固氮。DRS结果表明Ru掺杂提高了Bi₂O₃在可见光区域的光子吸收,减少了带隙宽度。导带位置比N₂/NH₃的还原电位(-0.05 eV)更负,热力学上更有利于氮还原反应。Ru掺杂的导带更负,热力学上更有利,导致Ru-Bi₂O₃具有更好的氨生产活性。
图5: 光催化机理研究
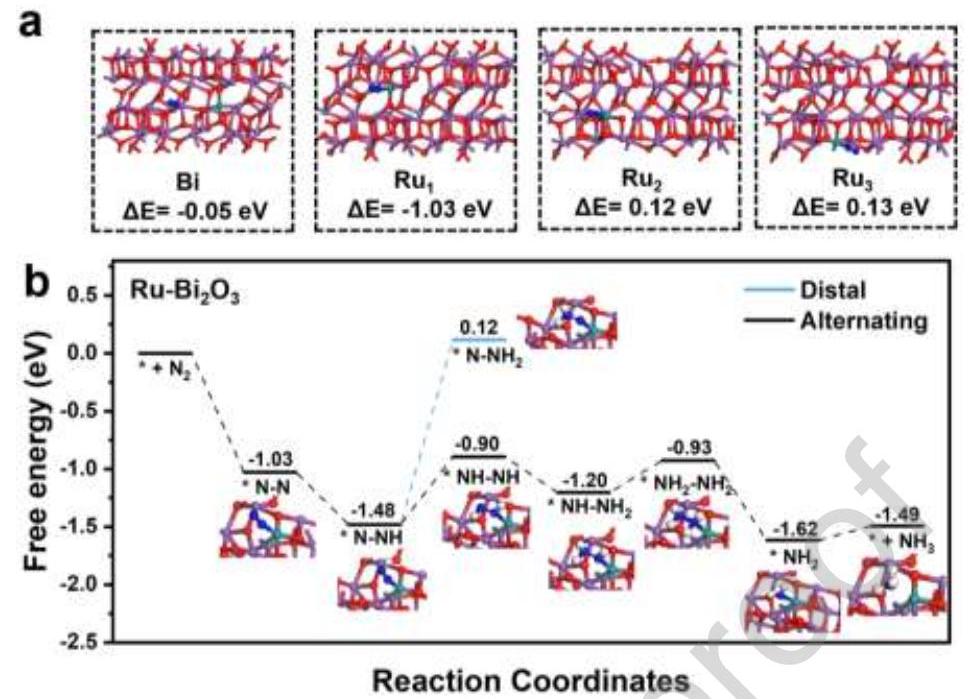
图5. (a) Ru-Bi₂O₃上不同位点的N₂吸附能, (b) Bi₂O₃和Ru-Bi₂O₃上NRR的自由能图
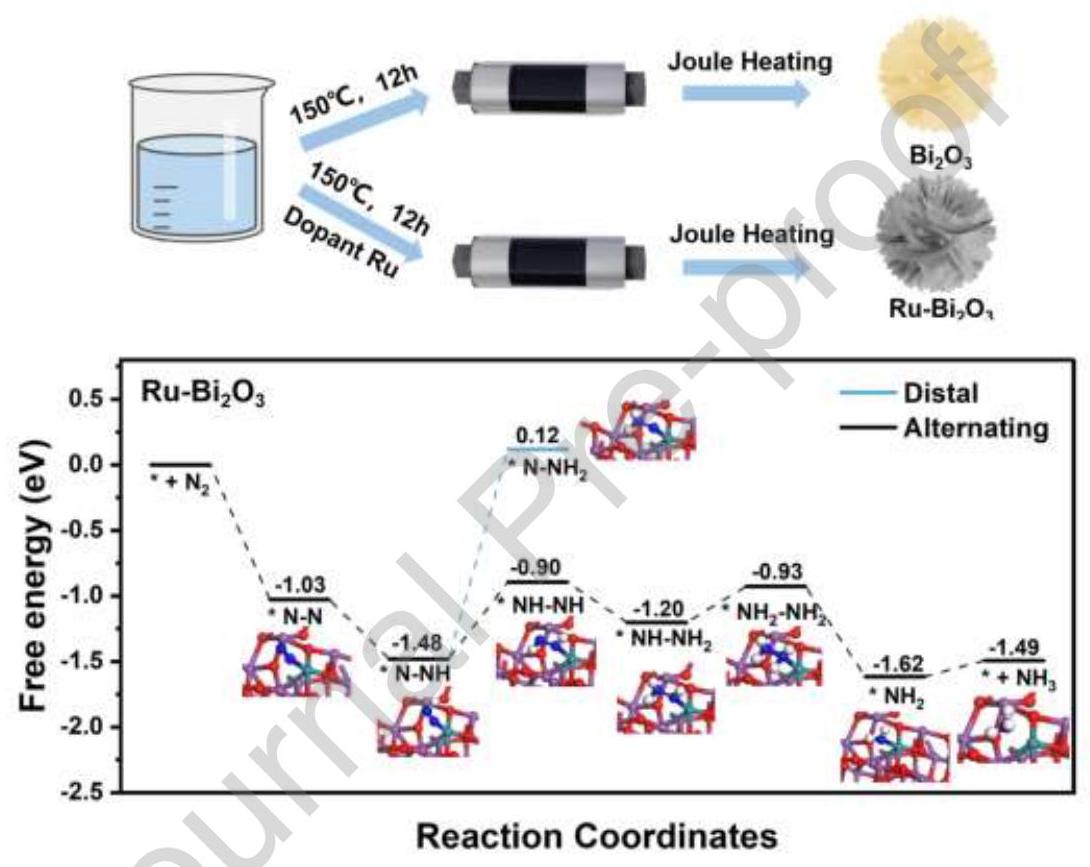
内容描述: 图5通过DFT计算研究了可能的吸附位点和电子转移。计算了Bi₂O₃上Bi位点、有空位的Bi₂O₃上Bi位点以及Ru-Bi₂O₃上不同Ru位点的吸附能(图5a)。发现存在空位时,Ru-Bi₂O₃中的Ru位点(Bi-O-Ru桥接吸附模式)是N₂最有效的吸附位点(ΔE = -1.03 eV)。自由能图(图5b)显示,Ru-Bi₂O₃上N₂的初始吸附过程释放1.03 eV能量,通过电荷重新分布极化N₂分子。*N-N → *N-NH步骤完全无势垒。形成*NHNH和*NNH₂的自由能变化分别为0.586 eV和1.597 eV,表明NRR更倾向于通过交替途径进行。
分析结果: DFT计算表明,Ru-Bi₂O₃中的Bi-O-Ru位点是N₂的最佳吸附位点,吸附能为-1.03 eV。自由能分析显示,交替固氮途径(*N₂ → *NNH → *NHNH → *NHNH₂ → *NH₂NH₂ → NH₃)比远端途径更有利。速率决定步骤是*N-NH → *NH-NH,势垒为0.58 eV。Ru掺杂降低了反应势垒和氢化反应电位,促进了N₂的化学吸附和活化。Ru-Bi₂O₃活性的显著增强归因于*H的充分供应,极大促进了氨的形成。
图形摘要
图形摘要:Ru-Bi₂O₃光催化固氮过程示意图
内容描述: 该图形摘要展示了Ru-Bi₂O₃催化剂光催化固氮的整体过程。示意图显示了Ru掺杂和氧空位协同作用促进N₂吸附和活化,光生电子-空穴对分离增强,以及最终生成NH₃的过程。
分析结果: 图形摘要直观地总结了本研究的核心发现:通过快速焦耳加热法制备的Ru-Bi₂O₃具有丰富的氧空位和电子富集的Ru位点,这些特征共同促进了N₂的吸附和活化,降低了反应能垒,提高了光催化固氮效率和选择性。





