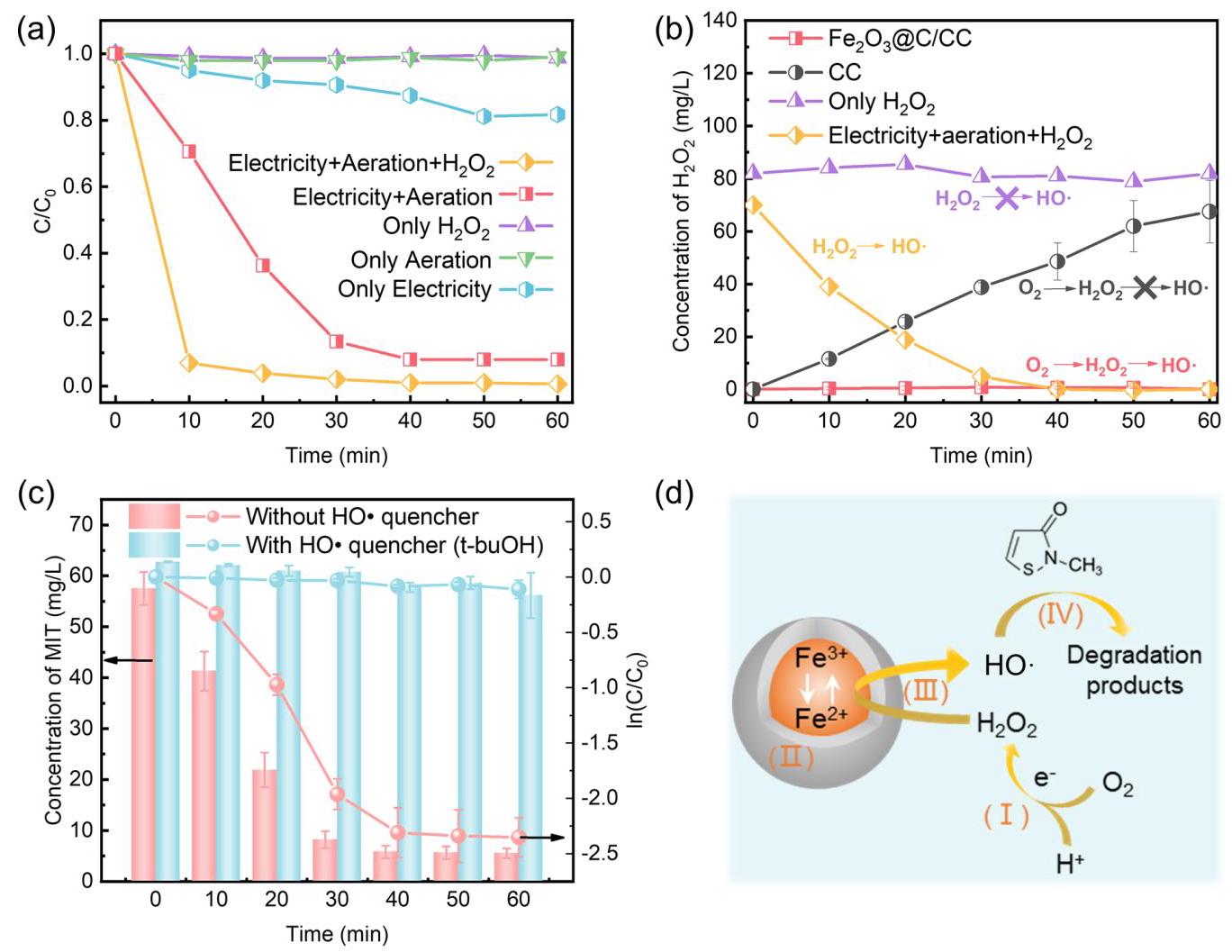
材料合成示意图与形貌表征
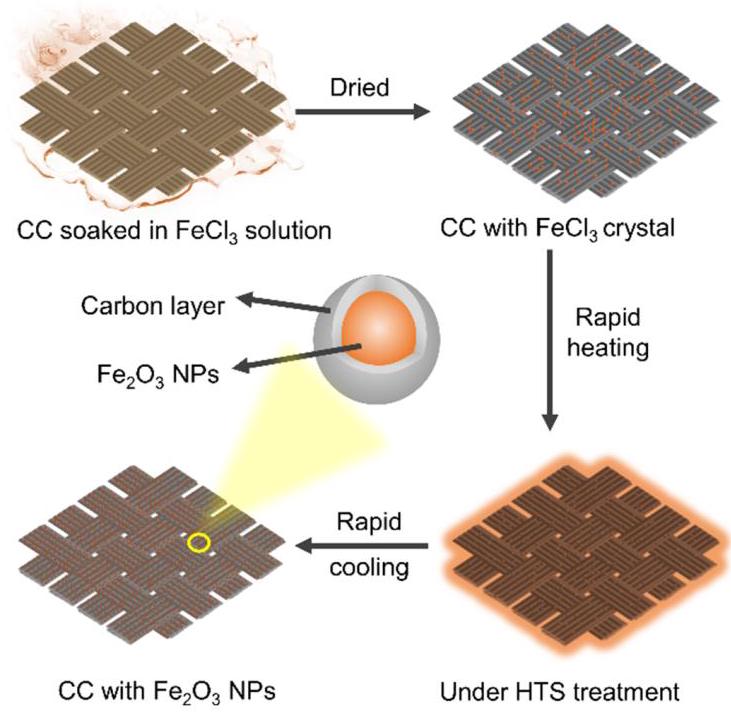
图1: Fe₂O₃@C/CC合成路线示意图。将负载FeCl₃的碳布进行高温冲击处理,快速生成被碳层包裹的Fe₂O₃纳米颗粒。
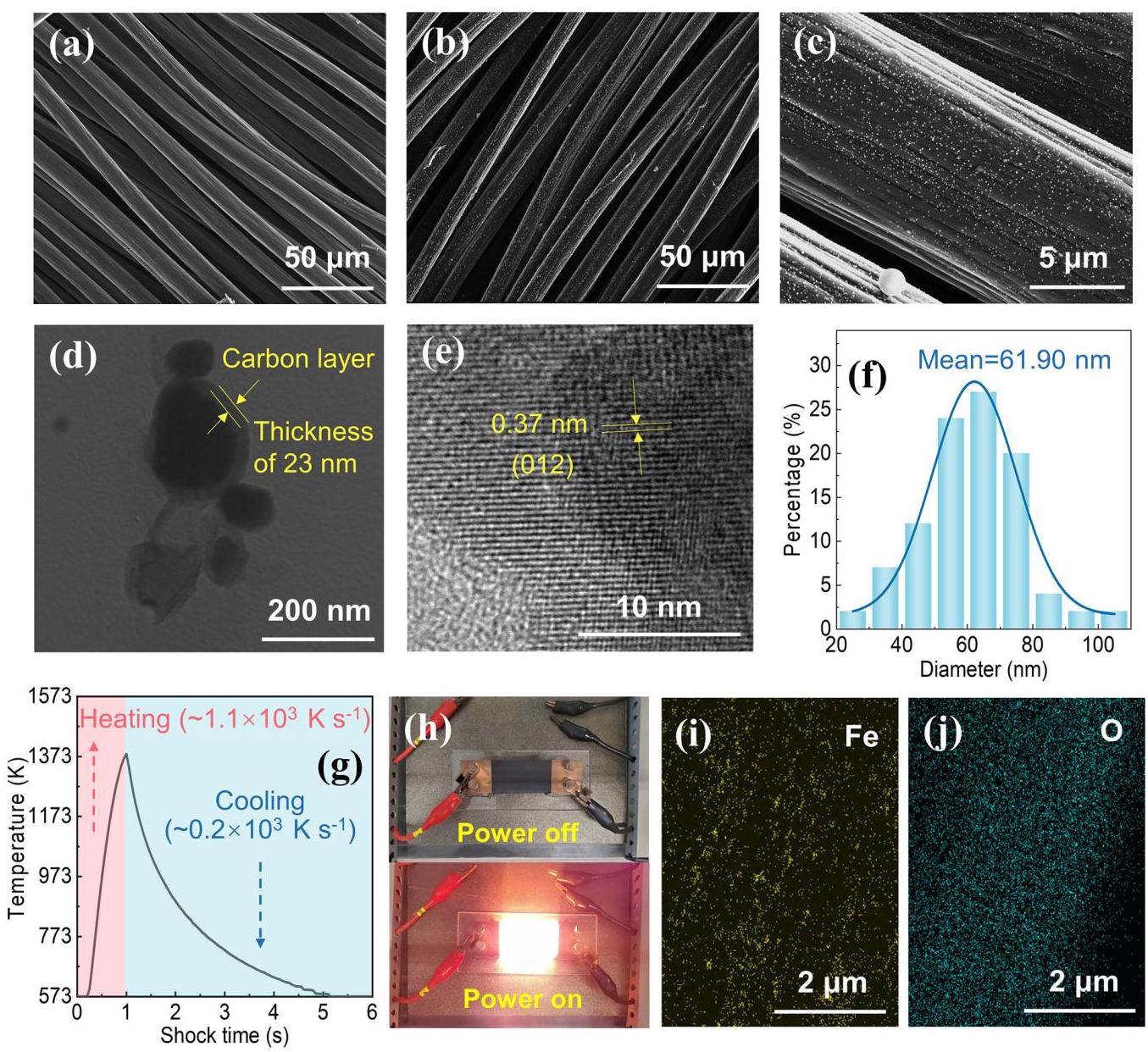
图2: (a) CC阴极的SEM图像。(b)-(c) HTS制备的Fe₂O₃@C/CC阴极的SEM图像,显示纳米颗粒均匀分布。(d) Fe₂O₃@C NPs的TEM图像。(e) Fe₂O₃@C NPs的HRTEM图像,显示晶格条纹。(f) Fe₂O₃@C NPs的粒径分布。(g) HTS过程中温度随时间的变化。(h) HTS过程中阴极的数字照片。(i)-(j) Fe₂O₃@C/CC阴极中元素的EDX mapping。
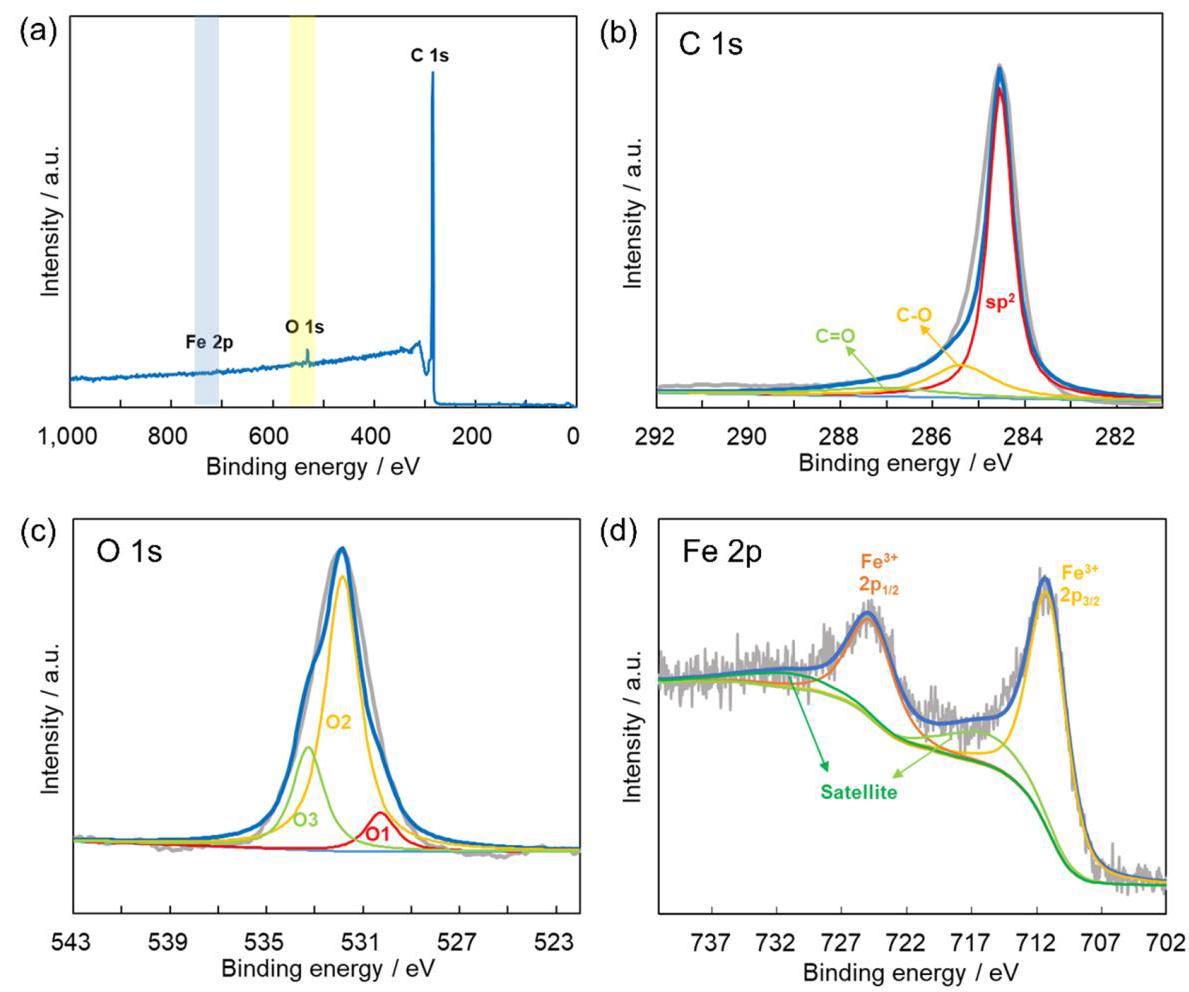
分析结果: HTS过程成功在碳布上合成了均匀分布的Fe₂O₃纳米颗粒,平均尺寸约为62 nm,并被约23 nm厚的碳层包裹,形成了核壳结构(Fe₂O₃@C)。HRTEM显示清晰的晶格条纹(0.37 nm),对应于Fe₂O₃的(012)晶面。EDX mapping证实Fe和O元素均匀分布,且Cl元素在HTS过程中已挥发。温度监测显示超快的升温和冷却速率(~10³ K/s)。